治愈I型糖尿病 这次真的有希望

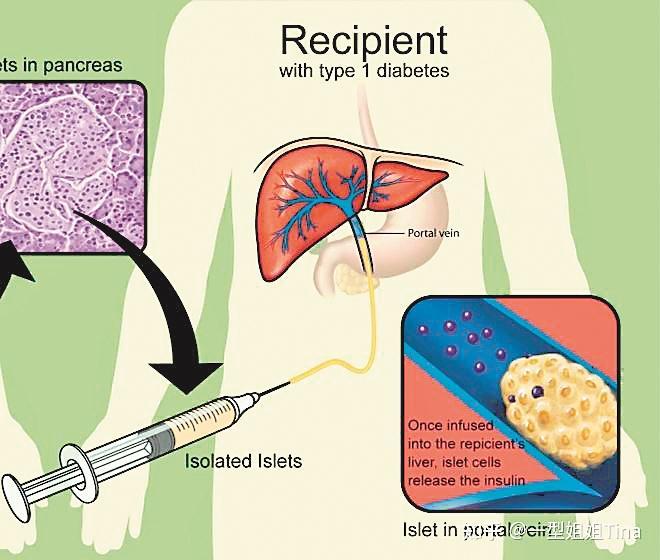
糖尿病是全球影响最广的慢性代谢疾病之一,给患者和社会造成沉重的负担。I型糖尿病患者由于自身免疫原因,造成胰岛细胞无法正常生产胰岛素,须长期依赖外源胰岛素的持续输注,又被称为胰岛素依赖糖尿病。胰岛细胞移植被证明是帮助I型糖尿病患者摆脱胰岛素依赖的有效手段,但是面临免疫抑制剂毒副作用和胰岛来源不足等问题。最近,美国、瑞典和中国等多个研究团队已在I型糖尿病胰岛细胞移植疗法方面取得突破性进展,为实现I型糖尿病长期疗效甚至治愈带来了新的希望,相关研究成果发表在《新英格兰医学杂志》等国际著名学术期刊上。
胰岛细胞移植“有难处”
I型糖尿病属于自身免疫性疾病,由于自身免疫细胞错误攻击,破坏了产生胰岛素的胰岛细胞,导致患者体内胰岛素绝对缺乏,因此患者必须终身依赖胰岛素替代治疗,通常需每天注射胰岛素,导致患者面临生活质量降低、严重心血管风险增加、寿命缩短等诸多不利影响。由于I型糖尿病患者多发病于青少年时期,病痛往往伴随一生,因此摆脱胰岛素的依赖,实现血糖正常是I型糖尿病患者的普遍愿望。
自20世纪70年代以来,科学家和医生一直在尝试利用胰岛细胞移植来治疗I型糖尿病。迄今为止,全球已有两千多位I型糖尿病患者接受了胰岛细胞移植治疗。这些临床研究结果显示,同种异体胰岛细胞移植后可在患者体内持久存活,并在大多数患者没有严重低血糖的情况下实现血糖控制目标。有一些患者还表现出长期疗效,例如一项加拿大研究中心长达20年的随访研究显示,在255名接受胰岛细胞移植的I型糖尿病患者中,约有80%的患者在7.4年的中位随访时间中摆脱了胰岛素依赖,约有70%的移植物持续发挥生产胰岛素的功能。
不过,目前胰岛细胞移植面临两大难题:一是免疫抑制剂毒性问题,因为胰岛细胞移植受体对同种异体胰岛细胞通常会产生免疫排斥反应,必须大量注射有毒副作用的免疫抑制剂,限制了胰岛细胞移植疗法的广泛应用;另一方面是胰岛细胞供体不足的问题,由于目前用于临床治疗的胰岛细胞大多来自遗体捐献者,以及少数健康捐献者,胰岛细胞供体来源短缺非常严重。
令人振奋的是,科学家找到了解决这两个难题的重大突破口,答案都在《新英格兰医学杂志》上。其中,美国萨那生物技术公司索尼娅·施雷普弗博士和瑞典乌普萨拉大学佩尔-奥拉·卡尔松博士领衔的研究小组开展了首例基因编辑胰岛细胞的临床试验,在无须免疫抑制剂的情况下,移植物既没有受到患者免疫系统攻击,又在患者体内发挥出正常功能,有效降低了血糖浓度。另一项重磅突破则是中国和美国科学家采取人干细胞来源的胰岛细胞移植,均在临床试验中取得重大进展。
基因编辑“障眼法”
为了解决免疫排斥难题,美国Sana生物技术公司施雷普弗博士领导的研究团队设计了一种低免疫平台胰岛细胞移植方案,即利用CRISPR/Cas12b对志愿者捐献的胰岛细胞进行基因编辑,敲除B2M和CIITA基因以逃避适应性T细胞的攻击,但可能引发固有免疫杀伤作用,因此再通过转导慢病毒载体过度表达CD47来避免这种固有免疫杀伤,研究人员希望这种经过基因编辑的低免疫胰岛细胞在移植之后,不再引发胰岛细胞移植受者的免疫排斥反应。
此前,研究团队已在人源化糖尿病小鼠模型上验证了这一创新疗法的可行性。随后,研究人员将这种创新疗法在非灵长类动物——食蟹猴身上进行了验证。与小鼠结果类似,基因编辑胰岛细胞移植到免疫功能正常的糖尿病食蟹猴身上之后,能正常分泌胰岛素,食蟹猴免疫系统同样没有识别出源于恒河猴的胰岛细胞,也没有对其进行杀伤。在移植6个月内,无须任何免疫抑制剂,食蟹猴的血糖都维持在较低水平。
在经过小鼠和食蟹猴的临床前动物试验验证之后,研究人员对一名42岁的长期I型糖尿病男性患者开展了同种异体胰岛细胞移植。胰岛细胞来自一名60岁的O型血男性捐献的胰脏,其糖化血红蛋白水平略高于正常值。研究人员从胰脏分离出胰岛细胞,并进行如前所述的基因改造,然后将基因编辑胰岛细胞注射到患者体内。患者没有接受任何糖皮质激素、抗炎药物或免疫抑制剂。
研究人员检测发现,在移植手术12周内,患者免疫系统并未对基因编辑胰岛细胞产生任何免疫排斥反应。相比移植前,患者餐后的胰岛素水平显著提高,而这些胰岛素均来自外源胰岛细胞,而且在第12周时,患者糖化血红蛋白下降了42%。
这是首次在不采用免疫抑制剂的情况下进行的同种异体胰岛细胞移植成功案例,显示该疗法具有较好的安全性,且展现出值得期待的疗效,基本达到了概念验证目的。
干细胞“障眼法”
除了基因编辑胰岛细胞移植取得重大进展之外,更令人期待的疗法是干细胞来源的胰岛细胞移植,有望解决胰岛供体短缺的问题。
据美国Vertex医药公司今年6月发表在《新英格兰医学杂志》上的一项重磅研究显示,该公司2021年启动的一项I型糖尿病胰岛细胞移植疗法临床1/2期试验取得令人振奋的进展。胰岛细胞由人类胚胎干细胞分化而来,且体外实验显示这种胰岛细胞能正常分泌胰岛素。在接受干细胞衍生的胰岛细胞移植以及全剂量免疫抑制剂之后,12名I型糖尿病患者的外源胰岛素依赖得到了不同程度的缓解,其中有10位患者在1年的随访期内完全摆脱了外源胰岛素的依赖,且血糖控制达到预期推荐目标。
上述研究是利用人类胚胎干细胞,不过胚胎干细胞是从人类胚胎分离而来,来源仍然较为有限,且存在伦理争议,而来源于人类体细胞的诱导多能干细胞则能有效规避胚胎干细胞的风险。
据2024年9月在线发表于国际权威期刊《细胞》上的研究论文显示,北京大学邓宏魁教授与天津市第一中心医院沈中阳、王树森研究组等组成的研究团队,全球首次利用诱导多能干细胞衍生胰岛细胞移植实现了I型糖尿病临床功能性治愈的疗效。研究人员首先将一名25岁I型糖尿病女性患者的脂肪细胞诱导成为一类多能干细胞——间充质干细胞,然后采用化学重编程技术使得诱导多能干细胞分化为具有胰岛素分泌功能的胰岛细胞,再将患者自体干细胞衍生的胰岛细胞回输到患者体内,同时给予免疫抑制剂。该患者在移植75天后开始减少胰岛素依赖。4个月后,患者血糖达标的时间从开始的43%增加到 96%,而且糖化血红蛋白大幅下降。此后,患者呈现稳定的血糖控制状态,血糖达标时间超过98%。
上述研究显示,无论是基因编辑胰岛细胞,还是干细胞衍生胰岛细胞,均具有帮助I型糖尿病患者摆脱胰岛素长期依赖的潜力,甚至有治愈I型糖尿病的希望。不过,这些结果毕竟只是个案或者早期临床试验,还需要更多患者参与、更大规模的临床试验加以验证,让我们拭目以待。
汤波